
AUTEUR DE L’ARTICLE
Dr Vet Florian BEDEL, Résident en Médecine Interne (ECVIM)
Introduction
L’hypercoagulabilité est définie comme une génération excessive et inappropriée de thrombi, ces derniers étant les produits finaux de la coagulation. En médecine vétérinaire, de nombreuses affections peuvent entraîner un état dit « pro-coagulable » (ou pro-thrombotique), augmentant le risque de formation de thrombi. Cliniquement, la présence d’un ou plusieurs thrombi n’est pas simple à diagnostiquer, les signes cliniques pouvant être variés, tardifs et non spécifiques. Il est donc important de connaître les affections pro-thrombotiques fréquemment rencontrées en médecine canine et féline afin de mieux prévenir l’apparition de ces désordres de la coagulation.
L’apparition soudaine de signes neurologiques, la détérioration progressive d’une fonction organique (exemple : évolution d’une maladie rénale chronique auparavant stable après un infarctus rénal) ou un dysfonctionnement organique aigu et inattendu (exemple : détresse respiratoire aiguë lors d’une thromboembolie pulmonaire) peuvent donner des indices sur la présence d’une hypercoagulabilité.
Physiopathologie
L’hypercoagulabilité est souvent favorisée par une ou plusieurs anomalies de la triade de Virchow, à savoir :
- une augmentation de la coagulabilité (activation accrue des plaquettes ou des facteurs de coagulation, déficit en facteurs anticoagulants ou inhibition de la fibrinolyse)
- une stase vasculaire
- une lésion de l’endothélium vasculaire
La thrombose fait référence à la formation d’un caillot sanguin (thrombus) au sein d’un vaisseau, entraînant une obstruction du flux sanguin. Lorsqu’un caillot sanguin est délogé de son origine et se déplace vers un site distant dans la circulation, on parle de thromboembolie.
Les affections pouvant être à l’origine d’un état hypercoagulable sont les suivantes :
- Syndrome inflammatoire systémique :
- SIRS (syndrome de réponse inflammatoire systémique)
- Sepsis
- Anémie hémolytique à médiation immune (AHMI)
- Pancréatite aiguë
- Trauma
- Autres processus inflammatoires sévères
- Entéropathie exsudative (« protein-losing enteropathy »)
- Glomérulopathie (« protein-losing nephropathy »)
- Cardiomyopathie (hypertrophique, restrictive ou non classifiée > dilatée) ; principalement chez le chat
- Hépatopathie (notamment en cas d’hypertension portale)
- Dysendocrinies : hypercorticisme ; moins fréquemment rapporté : hypothyroïdie, diabète sucré
- Administration exogène de corticoïdes
- Processus néoplasiques
- Dirofilariose
- Endocardite
- Coagulation intravasculaire disséminée (phase initiale avec formation de microthrombi)
Lors d’AHMI, les thromboembolies pulmonaires sont les désordres hémostatiques les plus représentés, pouvant être à l’origine du décès de l’animal. De multiples études rapportent une forte prévalence des thromboembolies pulmonaires (jusqu’à 70 à 80 %) lors d’une évaluation nécropsique des chiens atteints d’AHMI. Le risque est majeur lors des 2 premières semaines après le diagnostic. Jusqu’à la moitié des décès liés à des thromboembolies surviennent même lorsqu’un traitement antithrombotique préventif est administré. Les mécanismes à l’origine d’un état hypercoagulable lors d’AHMI comprennent notamment une réactivité plaquettaire accrue, une expression accrue du facteur tissulaire et la mise en place d’une corticothérapie elle-même pro-thrombotique.
Dans l’espèce féline, la cardiomyopathie hypertrophique est largement rencontrée. Cette affection est couramment associée à un état hypercoagulable (jusqu’à 50 % des cas) pouvant mener à une thromboembolie aortique. Les mécanismes sous-jacents identifiés sont la dilatation de l’oreillette gauche entraînant une stase sanguine et un flux sanguin turbulent ; l’hyperactivité plaquettaire et les lésions endocardiques sont également suspectées comme éléments favorisant un état hypercoagulable.
Les endocrinopathies telles que le diabète sucré, l’hypothyroïdie et la maladie de Cushing sont reconnues comme étant pro-thrombotiques. Bien que les mécanismes soient encore mal compris et probablement multifactoriels, la présence d’athérosclérose pourrait contribuer à un état hypercoagulable chez ces patients.
Méthodes diagnostiques
La mise en évidence d’une hypercoagulabilité repose sur un ensemble de données anamnestiques, clinques et biologiques. La connaissance des facteurs prédisposants dans un contexte clinique précis permet souvent d’orienter le clinicien vers une suspicion d’hypercoagulabilité. Les examens biologiques proposés ci-dessous permettent de conforter la suspicion clinique.
Les tests de coagulation classiquement utilisés en médecine vétérinaire, à savoir la mesure du temps de prothrombine (PT ; également appelé temps de Quick, TQ) ou du temps de céphaline activée (aPTT ; également appelé TCA) sont insensibles pour déceler des états hypercoagulables et ne peuvent être utilisés dans ce contexte. Ils permettent de refléter le fonctionnement des voies intrinsèque, extrinsèque et commune de la coagulation, et sont uniquement utilisés pour identifier des états hypocoagulables.
Des concentrations élevées de D-dimères résultent de la lyse de la fibrine réticulée et suggèrent une formation excessive de thrombi, mais ce test a une faible spécificité pour les affections thromboemboliques.
A l’heure actuelle, l’identification d’un état hypercoagulable fait appel à des techniques de mesure de la viscoélasticité telle que la thromboélastographie (TEG) ou la thromboélastométrie (TEM). Ces techniques sur sang total décrivent la formation du caillot dès son apparition, tout au long du processus jusqu’à la fibrinolyse. Outre le fait d’être coûteux et difficiles d’interprétation, les résultats peuvent être influencés par différents facteurs comme une anémie, une hyperfibrinogénémie ou une thrombopénie. Par ailleurs, la réalisation de ce test nécessite l’utilisation de sang frais, empêchant l’envoi en laboratoire ; la disponibilité du test est donc réduite aux établissements possédant l’analyseur.
Thérapie antithrombotique
Les thérapies antithrombotiques utilisées sont à but préventif afin de limiter le risque d’apparition ou d’aggravation d’un thrombus pré-existant. Les traitements fibrinolytiques, d.ont le but est de détruire un thrombus déjà formé, ne sont pas couramment utilisés en médecine vétérinaire, ce sujet ne sera donc pas abordé dans cet article.
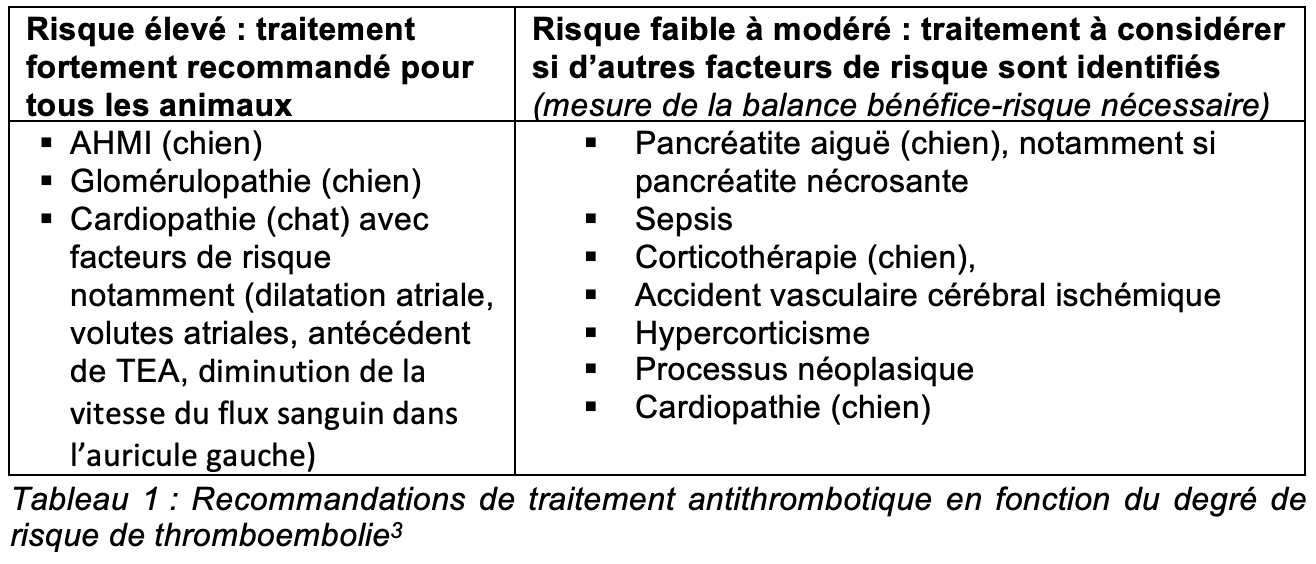
Les recommandations de traitement varient selon les affections et sont rassemblées dans le tableau 1 ; elles sont tirées des recommandations CURATIVE de 20183.
Bien qu’aucune recommandation de traitement ne soit faite dans le contexte des entéropathies avec perte de protéines dans les recommandations CURATIVE, plusieurs études mettent en évidence un état hypercoaguable dans ces affections4. Il est donc raisonnable de considérer un traitement anti-thrombotique dans le contexte d’une entéropathie avec perte de protéines.
Le choix de la thérapie antithrombotique repose, en grande partie, sur la localisation observée ou attendue des thrombi. Nous distinguerons un thrombus veineux ou pulmonaire d’un thrombus artériel. Lors de maladies associées à des thromboembolies veineuses (TEV) ou pulmonaires (TEP), telles que la néphropathie par perte de protéines et l’anémie hémolytique à médiation immunitaire (AMHI) chez le chien, les thrombi se forment dans des conditions de faible cisaillement. Ces thrombi sont généralement riches en fibrine et leur formation dépend peu du nombre ou de la fonction des plaquettes. A l’inverse, dans les maladies associées à des complications thrombotiques artérielles (telles que les cardiomyopathies félines), les thrombi se forment dans des conditions de cisaillement élevé. Les thromboembolies artérielles (TEA) sont généralement riches en plaquettes et les médicaments qui limitent la capacité des plaquettes à s’activer, à s’agréger ou à adhérer sont donc les plus efficaces. C’est ce raisonnement physiopathologique qui est à l’origine d’un consensus d’administration d’anticoagulants dans la thrombose veineuse, et d’antiagrégants plaquettaires dans la thrombose artérielle (Tableau 2). Toutefois, ces notions de base sont bien plus complexes dans le modèle in vivo, des thrombi à la fois veineux et artériels pouvant être observés dans de multiples affections (ex : AHMI), conduisant souvent à une utilisation simultanée d’antiagrégants plaquettaires et d’anticoagulants, après évaluation de la balance bénéfice/risque concernant l’apparition d’hémorragies. Il existe par ailleurs des preuves chez l’homme d’une efficacité croisée entre anticoagulants et antiagrégants plaquettaires.
Les doses recommandées sont rassemblées dans le tableau 3.

Agents antithrombotiques lors de thrombus veineux2 :
Chez le chien : Il est recommandé d’utiliser des anticoagulants qui semblent être plus efficaces que les antiagrégants plaquettaires pour la prévention de la TEV en général.
Chez le chat : Il est recommandé d’utiliser des anticoagulants plutôt que des antiagrégants plaquettaires pour la prévention de la TEV chez le chat. Aucune recommandation fondée sur des preuves ne peut être faite concernant l’utilisation d’antiagrégants plaquettaires dans le cadre de TEV chez le chat.
Les héparines de bas poids molécules (HBPM) telles que la dalteparine et l’enoxaparine sont préférées aux héparines non fractionnées (HNF). Elles ont pour but d’exercer une activité inhibitrice sur le facteur Xa. En effet les HBPM apparaissent plus sécuritaires dans leur utilisation puisqu’elles ne nécessitent généralement pas de suivre l’activité du facteur Xa, et disposent d’une meilleure biodisponibilité.
La mise sur le marché d’un inhibiteur direct du facteur Xa sous forme orale (rivaroxaban) facilite la prise en charge des patients atteints de thrombi veineux. Son usage est supporté par la communauté scientifique, notamment afin de remplacer les héparines non fractionnées.
La figure ci-dessous permet d’illustrer le site d’action du clopidogrel (inhibition du récepteur de l’adénosine diphosphate P2Y12), de l’aspirine (inhibition de la formation de thromboxane A2 par les plaquettes) et celui du rivaroxaban (inhibition du facteur Xa).
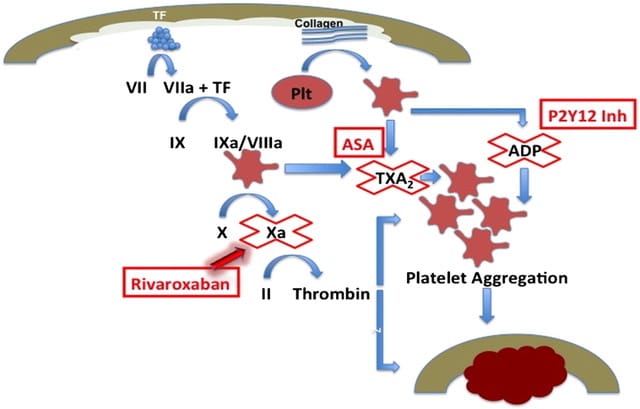
Figure I : Sites d’action des agents antithrombotiques. ASA = aspirine, TXA2 = thromboxane A2, P2Y12 inh = clopidogrel. TF = facteur tissulaire. (Source : Povsic TJ, Roe MT, Ohman EM et al (2016). A randomized trial to compare the safety of rivaroxaban vs aspirin in addition to either clopidogrel or ticagrelor in acute coronary syndrome: The design of the GEMINI-ACS-1 phase II study. American heart journal, 174, 120–128.)
Agents antithrombotiques lors de thrombus artériel2 :
Chez le chien : Il est recommandé d’utiliser les antiagrégants plaquettaires qui s’avèrent être plus efficaces que les anticoagulants pour la prévention de la TEA. Toutefois les anticoagulants se montrent également efficaces pour la prévention de la TEA chez le chien et peuvent y être combinés.
Chez le chat : L’usage d’antiagrégants plaquettaires est recommandé afin de prévenir la TEA, notamment lors de cardiomyopathies félines. Les preuves scientifiques concernant l’usage des anticoagulants dans la TEA sont trop faibles chez le chat pour suggérer leur usage en première intention.
Par ailleurs, lors de TEA chez le chat, l’usage du clopidogrel est préférable à celui de l’aspirine (étude FAT CAT5 : chez le chat atteint de cardiomyopathie, l’utilisation de clopidogrel conduit à une meilleure durée de survie et durée avant récidive de la TEA, en comparaison avec l’utilisation d’aspirine).
Bien que de nouvelles molécules prometteuses soient disponibles sur le marché pharmaceutique, à l’heure actuelle l’usage d’abciximab et de ticagrelor n’est pas recommandé chez les animaux de compagnie.
La combinaison d’antiagrégants plaquettaires et d’anticoagulants peut être envisagée chez des patients à haut risque de thrombose. Toutefois une évaluation de la balance bénéfice/risque concernant des hémorragies liées à la combinaison des traitements doit être faite.

Références bibliographiques :
- Blois S. Hyper- and Hypocoagulable States. In: Ettinger SJ, Feldman EC, Cote E, editors. Textbook of Veterinary Internal Medicine. 8th ed. St Louis (MO): Elsevier; 2017. p.822-829
- Goggs R, Bacek L, Bianco D et al. Consensus on the Rational Use of Antithrombotics in Veterinary Critical Care (CURATIVE): Domain 2-Defining rational therapeutic usage. J Vet Emerg Crit Care (San Antonio). 2019 Jan;29(1):49-59.
- deLaforcade, A., Bacek, L., Blais, M. C, etal(2019). Consensus on the Rational Use of Antithrombotics in Veterinary Critical Care (CURATIVE): Domain 1-Defining populations at risk.J Vet Emerg Crit Care (San Antonio). 2019 Jan;29(1), 37–48.
- Goodwin LV, Goggs R, Chan DL, & Allenspach K (2011). Hypercoagulability in dogs with protein-losing enteropathy. Journal of veterinary internal medicine, 25(2), 273–277.
- Hogan DF, Fox PR, Jacob K et al. Secondary prevention of cardiogenic arterial thromboembolism in the cat: The double-blind, randomized, positive-controlled feline arterial thromboembolism; clopidogrel vs. aspirin trial (FAT CAT). J Vet Cardiol. 2015 Dec;17 Suppl 1:S306-17.
- Blais MC, Bianco D, Goggs R et al. Consensus on the Rational Use of Antithrombotics in Veterinary Critical Care (CURATIVE): Domain 3-Defining antithrombotic protocols. J Vet Emerg Crit Care (San Antonio). 2019 Jan;29(1):60-74



